Japan
サイト内の現在位置を表示しています。
業種別PLMソリューション
医療機器業向けPLMソリューション
北米に進出する医療機器メーカーに求められる『FDA Part11』適合を支援
医療機器業界では、コンピュータシステムを用いる場合は「ER/ES(電子記録/電子署名)」が基本的に求められ、その対応が急務とされています。
「Obbligato/医療機器業向けPLMソリューション」は、『FDA 21CFR Part11』に求められる機能要件を標準機能としてご提供しております。医療機器メーカに求められる『FDA 21CFR Part11』適合を推進し、技術情報の電子化、業務効率化、品質向上を支援します。
医療機器業向けPLMテンプレート
医療機器業界で培った豊富な成功事例をもとにしたシステム導入ノウハウを活かし、ER/ES(電子署名・監査証跡)に対応します。医療機器の設計情報を一元管理し、医療機器規制に求められるER/ESに対応したシステムを早く安価に構築します。
医療機器業におけるFDA 21CFR Part11とは?
FDA Part11とは、FDA(Food and Drug Administration:米国食品医薬品局)が要求する21CFR Part11(米国連邦規則 第21章 第11条規則)です。
下記を満たせば電子記録・電子署名を紙と同等に扱う事を認めるとされています。
- バリデーションされていること
- 電子記録の正確で完全なコピーができること
- システムへのアクセス制限、セキュリティの確立
- 監査証跡を作成すること
- 開発者、使用者はPart11についての教育を受けること 等
特長
-
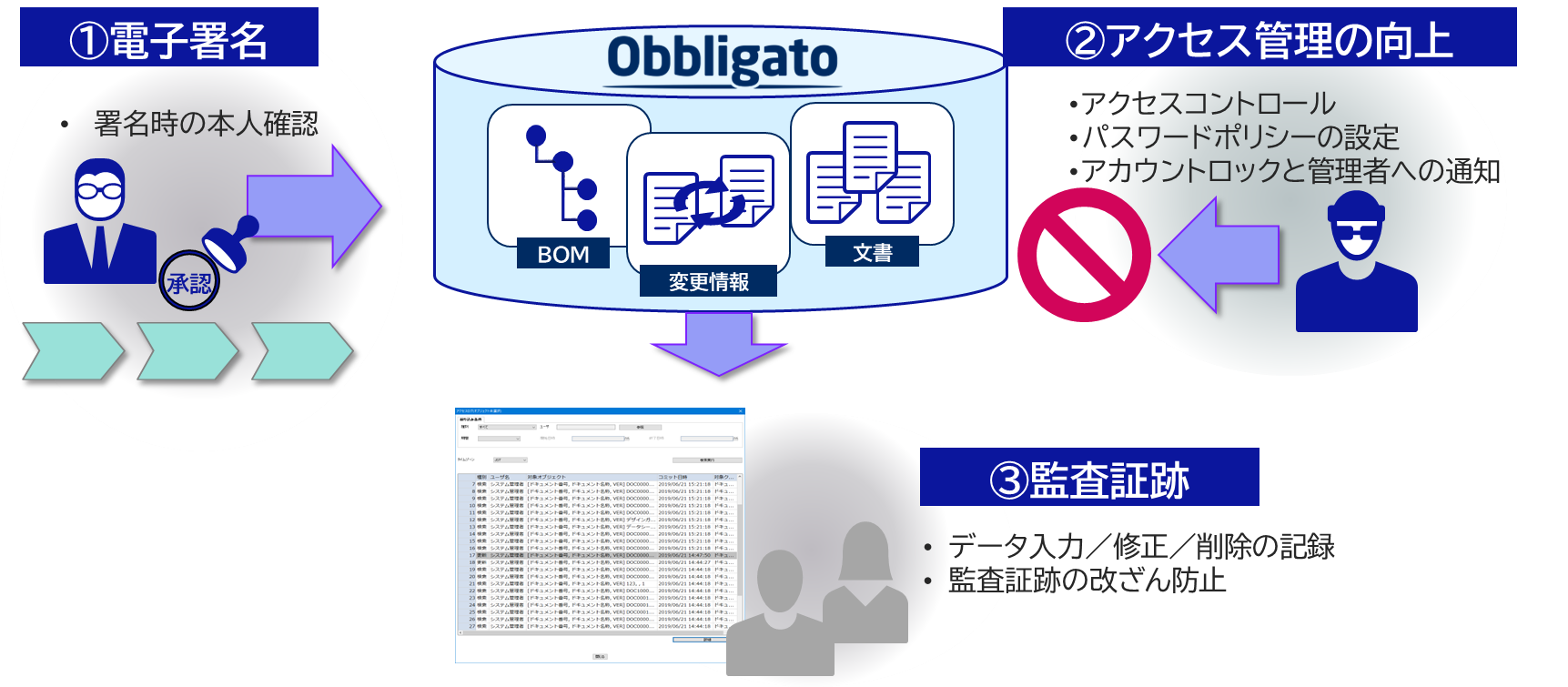
Part11適合支援
・監査証跡:データの入力/修正/削除、監査証跡の改ざん防止
・電子記録/電子署名:IDパスワードによる本人認証、パスワードによる電子署名
・アクセス管理:パスワードポリシー要件の指定、不正アクセス時のアカウントロックと管理者通知
導入事例
| オリンパス様 |
医療事業の修理業務における保守パーツ管理により、パーツリスト作成やマニュアルデータ管理工数を削減。変更通知作成や拠点への配信登録作業が約50%改善。医療事業におけるCSV(Computer System Validation)対応、既存ソフトウェアの回顧的バリデーション対応。 |
|---|---|
| 日機装様 |
米国「FDA 21 CFR Part11」に対応可能なPLMシステムを構築。医療機器ビジネスのグローバル展開を加速。事業全体において、品質に対する意識改革を実現。 |
 クリックして拡大表示する
クリックして拡大表示する 本事例のPDFを開く(964KB)
本事例のPDFを開く(964KB)